-
[유기화학] 1. 구조와 결합(2) - 이온결합, 공유결합, 원자가결합이론, 혼성오비탈, 분자궤도함수전공/유기화학 2019. 12. 9. 16:48728x90반응형
1. 이온결합
- 양이온, 음이온이 화합물 내에서 정전기적 인력에 의해 서로 붙들려 있는 결합
ex) Na+ + Cl- => NaCl
2. 공유결합
- 전자를 서로 공유해서 결합을 이룸.
- 전자-점구조식과 선-결합구조식으로 공유결합을 나타낼 수 있음.
맥머리의 유기화학 27p 3. 원자가 결합 이론(VBT)
- 두 원자가 서로 접근하여 한 워자에 전자 한 개가 들어있는 궤도함수와 다른 원자의 한 개 전자가 들어 있는 궤도함수가 서로 겹쳐질 때 공유결합이 형성된다.
- σ - 결합: 두 개의 권자 궤도함수의 정면 겹침에 의해 형성된 결합
- 두 오비탈이 겹쳐지기 시작함에 따라 에너지는 방추로디고 안정성은 증가된다.
∴ 각 원자의 전자는 자신의 원자핵과 다른 원자의 양으로 하전된 원자핵에 끌리기 때문.
- 양으로 하전된 두 원자핵에 대해서 음으로 하전된 전자가 끌리므로 원자들은 서로를 붙잡는다.
- 원자들이 너무 가까워져서 양으로 하전된 두 원자핵이 서로 반발을 시작하기 전까지 오비탈이 겹칠수록 에너지는 감소됨.
4. 혼성오비탈
1) sp3
- 공간적으로 정사면체로 배열된 새로운 궤도함수
- 단일결합으로 이루어져 있음
2) sp2
- 2s 궤도함수 중에서 두 개의 2p 궤도함수만 조합되어 있음.
- sp2혼성 두 개의 탄소가 서로 접근하면 sp2-sp2 정면 겹침에 의한 강한 σ - 결합을 형성.
- 각 탄소의 혼성화되지 않은 p 궤도함수는 서로 접근하여 측면으로 겹쳐져 π - 결합을 형성.
- 이중결합으로 이루어져 있는 경우
맥머리의유기화학 그림1.13 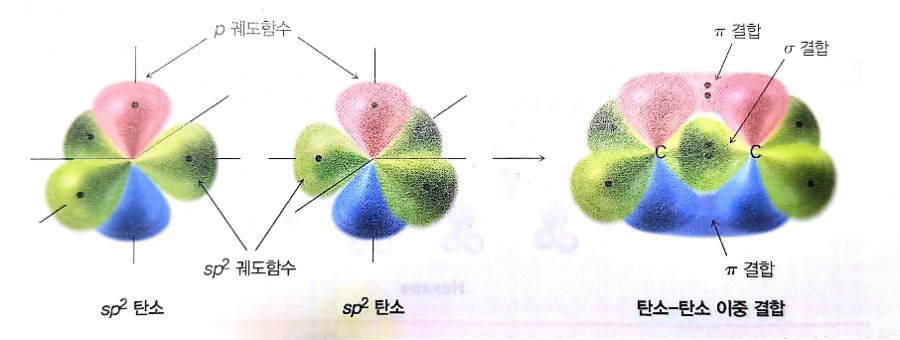
맥머리의유기화학 그림1.14 3) sp
- 삼중결합으로 이루어져 있는 경우
- 두 개의 혼성 궤도함수가 생기고 두 개의 p 궤도함수는 혼성화되지 않고 남아 있다.
맥머리의 유기화학 그림1.15 - sp 혼성 궤도함수 한 개씩 정면으로 서로 겹쳐져 강한 sp-sp σ-결합을 형성.
- 각 탄소의 pz-pz π-결합을 만들고, py-py π-결합을 형성.
- 평면구조, 직선구조
맥머리의 유기화학 그림 1.16 5. 분자 궤도함수 이론
1) 결합성 MO : 원소의 궤도함수보다 에너지가 낮은 분자궤도함수2) 비결합성 MO: 원소의 궤도함수보다 에너지가 높은 분자궤도함수, 두 핵 사이의 가운데에 전자가 존재 할 수 없는 마디가 존재한다. 이는 결합에 기여할 수 없고 반발한다.

맥머리의유기화학 그림1.17 
맥머리의유기화학 그림1.18
[참고문헌]
맥머리의 유기화학, 화학교재연구회, 사이플러스, 26-54p728x90반응형'전공 > 유기화학' 카테고리의 다른 글
[유기화학] 4. 알케인(2) - 입체화학 (0) 2019.12.09 [유기화학] 4. 알케인 (1) - 명명법 (0) 2019.12.09 [유기화학] 3. 화학 작용기 (0) 2019.12.09 [유기화학] 2. 극성 공유 결합-형식전하, 산과 염기, 수소결합 (0) 2019.12.09 [유기화학] 1.구조와 결합(1) - 원자구조, 동위원소, 양자수, 전자배치규칙, 오비탈 (0) 2019.12.09