-
2020 소방간부 화학개론 (16번 ~ 20번)소방공무원/화학개론 2021. 12. 4. 16:47728x90반응형
16. 다음은 25 ℃에서 반응하는 3가지 열화학 반응식이다.
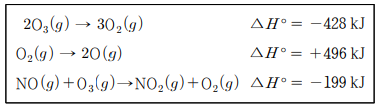
위의 자료를 이용하여 다음 반응의 표준 반응열(kJ)을 구하면? (단, ∆H ° 는 표준 반응열이다.)

답: -233kJ
풀이
NO(g) + O3(g) -> NO2(g) + O2(g) ∆H°=-199kJ
(2O(g) -> O2(g) ) ÷ 2 ∆H°=-496kJ ÷ 2
(3O2(g) ->2O3(g) ) ÷ 2 ∆H°=+428kJ ÷ 2
NO(g) + O(g) -> NO2(g) ∆H° = -199 -248 +214 = -233
17. 다음은 4가지 화학 반응식이다.

이에 대한 설명으로 옳지 않은 것은?
① (가)에서 N의 산화수는 감소한다.
② (나)에서 I2는 환원된다.
③ (다)에서 H2O는 환원제이다.
④ (라)에서 PbO는 산화제이다.
⑤ (가)∼(라)는 모두 산화 환원 반응이다.
답: 3번
풀이
③ (다)에서 NO2가 산화제, 환원제 역할을 한다
(가) N 의 산화수 : +1 -> 0 / O의 산화수 : -2 -> 0
(나) Al 의 산화수: 0 -> +3 / I의 산화수: 0 -> -1
(다) N의 산화수: +4 -> +3, +5 / H의 산화수: +1 / O의 산화수: -2
(라) Pb의 산화수; +2 -> 0 / N의 산화수: -3 -> 0 / H의 산화수: +1
18. 다음 중 입자 수가 다른 것은? (단, 모든 기체는 이상기체이며, H, C, N, O의 원자 량은 각각 1, 12, 14, 16이다.)
① 수소(H2) 1 g 속에 들어 있는 수소 원자의 수
② 0 ℃, 1 기압에서 22.4 L 용기 속에 들어 있는 수소 (H2) 기체의 분자 수
③ 메테인(CH4) 8 g을 완전 연소할 때 발생하는 물 (H2O) 분자의 수
④ 물(H2O) 18 g을 산소(O2)와 수소(H2)로 전기 분해 할 때 발생하는 수소(H2) 분자의 수
⑤ 과산화수소(H2O2) 34 g을 물(H2O)과 산소(O2)로 분해할 때 발생하는 산소(O2) 분자의 수
답: 5번
풀이:
PV=nRT
① 수소(H2) 1 g 속에 들어 있는 수소 원자의 수 = 0.5mol x 2 = 1mol
② 0 ℃, 1 기압에서 22.4 L 용기 속에 들어 있는 수소 (H2) 기체의 분자 수 = 1mol
③ 메테인(CH4) 8 g -> 0.5mol 을 완전 연소할 때 발생하는 물 (H2O) 분자의 수 = 1mol
④ 물(H2O) 18 g 1mol 을 산소(O2)와 수소(H2)로 전기 분해 할 때 발생하는 수소(H2) 분자의 수 = 1mol
⑤ 과산화수소(H2O2) 34 g 1mol 을 물(H2O)과 산소(O2)로 분해할 때 발생하는 산소(O2) 분자의 수 = 0.5mol
19. 25 ℃에서 아연(Zn)과 구리(Cu)를 전극으로 하는 화학 전지와 반쪽 반응의 표준 환원 전위(E° )를 나타낸 것이다.
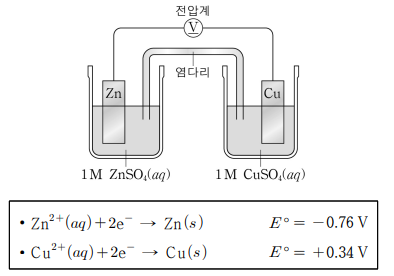
이에 대한 설명으로 옳은 것만을 <보기>에서 모두 고른 것은?
<보 기>
ㄱ. Zn 전극은 산화 전극이다.
ㄴ. 반응이 일어날 때, Cu 전극의 질량은 일정하다.
ㄷ. 표준 전지 전위(E◦전지)는 1V보다 크다.
답: ㄱ, ㄷ
풀이
E˚ 환원전위가 클수록 환원을 잘한다
Cu 전극은 환원전극 , Zn 전극은 산화전극
ㄴ. Cu2+ 이 환원됨으로써 Cu 가 됨으로 Cu전극의 질량은 증가한다
ㄷ. E◦전지 = 0.34 + 0.76 = 1.1V > 1V
20. 표는 25 ℃, 1 기압에서 2가지 이상기체에 대한 자료이다.
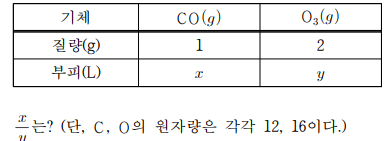
답: 6/7
풀이
PV=nRT = w/M RT , V = nRT/P , V ∝ n
CO 1g -> 1/28 mol
--------------------- = 6/7
O3 2g -> 2/48 mol
728x90반응형'소방공무원 > 화학개론' 카테고리의 다른 글
2021 소방간부 화학개론 (1번 ~ 5번) (0) 2021.12.05 2020 소방간부 화학개론 (21번 ~ 25번) (0) 2021.12.04 2020 소방간부 화학개론 (11번 ~ 15번) (0) 2021.12.04 2020 소방간부 화학개론 (6번 ~ 10번) (1) 2021.12.04 2020 소방간부 화학개론 (1번 ~ 5번) (0) 2021.12.04