-
2017 소방간부 화학개론 (11번 ~ 15번 )소방공무원/화학개론 2021. 12. 1. 12:17728x90반응형
11. 2N의 H2SO4 수용액 250mL를 만들려면 H2SO4는 몇 g이 필요한가? (단, H2SO4 분자량 = 98, N은 노말농도)
풀이:
노말농도는 용액 1L 속에 포함된 용질의 g당량수이다
g 당량수 = 분자량 / 당량수
2N = 2eq / 1L
H2SO4는 H+를 2개 내어놓을 수 있다. 즉 당량수 2eq / mol g당량수 = (98g/mol)/(2eq/mol)=49g/eq
2eq / 1 x 0.25L x (98g/mol)/(2eq/mol) = 24.5g
답: 24.5g
12. 다음 표는 A + B → C의 반응에서 A와 B의 초기 농도를 변화시키면서 측정한 초기 반응 속도를 나타낸 것이다. 이 반응의 속도식으로 옳은 것은? (단, 온도는 일정하며, 반응 속도 상수는 k라고 한다)

풀이:
[A]가 일정할 때 [B]의 농도가 2배가 될 때 C의 초기생성속도는 2배 증가했다 => B는 1차반응
[B]가 일정할 때 [A]의 농도가 2배가 될 때 C의 초기생성속도는 4배 증가했다 => A는 2차반응
답: v = k [A]2[B]1
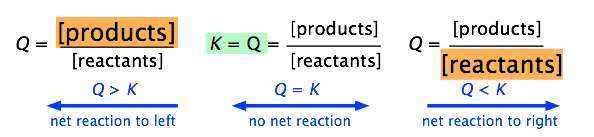
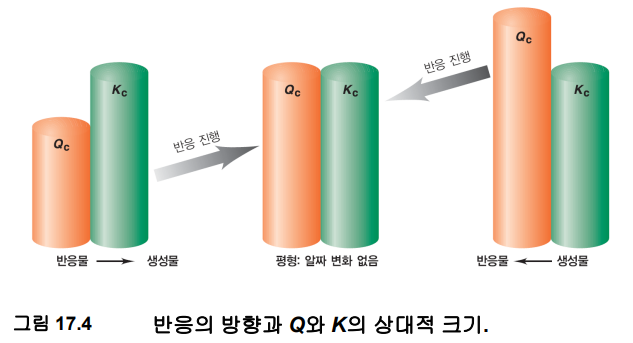
13. 일반적인 반응 aA + bB ⇄ cC + dD이 평형상태에 있다면, 이 때 반응지수 Q(reaction quotient)와 평형상수 K의 관계로 옳은 것은?
답: Q = K
< 반응지수와 평형상수의 관계 >
1. 평형상수

2. 반응지수
- 평형상수 K에서와 같은 방법으로 반응물에 대한 생성물의 비(반응 지수)를 계산

3. 평형상수와 반응지수의 관계


14. 중성 원자 (가)와 (나)가 다음의 물리적 성질을 가질 때, 옳게 설명한 것은?
(가)의 중성자 수는 8이고 전자 수는 7이다.
(나)의 양성자 수는 8이고 질량수는 18이다
① (가)의 양성자 수는 7이다.
② (나)의 원자 번호는 18이다.
③ (나)의 중성자 수는 8이다.
④ (가)와 (나)는 질량이 같다.
⑤ (가)와 (나)는 동위원소 관계이다.
답: 1번
풀이
양성자수 = 전자수
양성자수 + 중성자수 = 질량수
(가) 양성자수 = 7, 중성자수 = 8, 전자수 = 7 , 질량수 = 15 , 원자번호 = 7 -> N(질소)
(나) 양성자수 = 8, 중성자수 = 10, 전자수 = 8, 질량수 = 18 , 원자번호 = 8 -> O(산소)
15. 다음은 원소 주기율표의 일부이다. 이에 대한 설명으로 옳은 것은?

① 원자 반경은 F가 Li보다 크다.
② 이온 반경은 Na+가 F -보다 크다.
③ 1차 이온화 에너지는 Mg이 F보다 크다.
④ 2차 이온화 에너지는 Na이 Mg보다 크다.
⑤ O와 F로만 이루어진 화합물은 이온성 결합을 갖는다
답: 4번
풀이
① 원자 반경은 F가 Li보다 작다.
② 이온 반경은 Na+가 F -보다 작다. -> 음이온이 양이온보다 이온반경이 크다
③ 1차 이온화 에너지는 Mg이 F보다 작다
⑤ O와 F로만 이루어진 화합물은 이온성 결합을 갖지 못한다. 둘다 음이온이기 때문에
< 주기율표 >

< 원소의 주기성 >
1. 이온화에너지
- 바닥상태에 있는 기체 원자로부터 한 개의 전자를 제거하는데 필요한 최소에너지
- 같은 주기에서 원자번호가 증가할수록 유효핵전하가 증가함으로써 이온화에너지는 증가한다
- 같은 족에서 원자번호가 증가할수록 원자반지름이 커짐으로써 이온화에너지는 감소한다


- 순차적 이온화 에너지: IE1 < IE2 < IE3

3. 전자친화도
- 기체상태에 있는 원자가전자 하나를 받아 음이온을 형성할때 발생하는 에너지 변화
- 원소의 전자친화도가 (+)의 값이 클수록 전자를 받아들이는 능력이 좋다


4. 전기음성도
- 공유결합을 하는 원자가 전자를 자기쪽으로 끌어당기는 정도를 상대적 수치로 나타낸 것


- 같은 주기에서 왼쪽에서 오른쪽으로 갈수록 증가한다
6. 원자반지름
- 같은 주기에서 왼쪽에서 오른쪽으로 갈수록 유효핵전하가 증가함으로써 원자반지름은 작아진다
- 같은 족에서 아래로 갈수록 양자수가 증가하기 때문에 원자반지름은 증가한다

7. 이온반지름
- 양이온이 음이온보다 작다


8. 격자에너지
이온성 고체를 구성하는 이온들을 떼어내는 데 필요한 에너지의 양
 728x90반응형
728x90반응형'소방공무원 > 화학개론' 카테고리의 다른 글
2017 소방간부 화학개론 (21번 ~ 25번) (0) 2021.12.01 2017 소방간부 화학개론 (16번 ~ 20번) (0) 2021.12.01 2017 소방간부 화학개론 (6번 ~ 10번) (0) 2021.12.01 2017 소방간부 화학개론 (1번 ~ 5번) (0) 2021.12.01 2016 소방간부 화학개론 (21번 ~ 25번) (0) 2021.11.30