2020 소방간부 자연과학개론 (6번 ~ 10번)
6. 1 M의 NaOH 수용액 100 mL를 0.25 M의 H2SO4 수용액으로 중화하려고 한다. 완전히 중화하는데 필요한 산 수용액의 부피는 몇 mL인가?
답: 200mL
풀이
0.25 M × 2 = 0.5 N
=> 0.25 M H2SO4 용액 = 0.5 N H2SO4 용액
NV = N’V’
1N x 100mL = 0.5N x VmL
V = 100 / 0.5 = 200mL
7. 다음 화합물에 포함된 작용기가 아닌 것은?
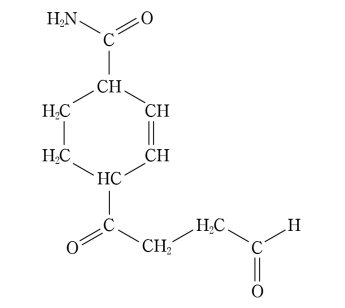
① 알켄(alkene)
② 에스터(ester)
③ 케톤(ketone)
④ 아마이드(amide)
⑤ 알데하이드(aldehyde)
답: 2번
풀이
8. 표는 A+ B → P 반응에서 반응물의 초기 농도에 따른 초기 반응 속도를 나타낸 것이다. 이에 대한 해석으로 옳은 것은? (단, k1: 속도 상수, [A] : A의 몰 농도, [B] : B의 몰 농도)

① 반응 속도식은 k[A][B]로 표현된다.
② 이 반응의 전체 반응 차수는 2차이다.
③ 이 반응은 B에 대한 1차 반응이다.
④ 이 반응은 A에 대한 1차 반응이다.
⑤ A의 반감기는 일정하다
답: 2번
풀이
A 농도가 일정할 때 B의 농도가 변했음에도 초기반응속도가 변하지 않았다 -> B는 0차 반응이다
B 농도가 일정할 때 A의 농도가 2배 증가했을때 초기반응속도가 4배 증가했다 -> A는 2차 반응이다
V = k[A]^2[B]^0
① 반응 속도식은 V = k[A]^2로 표현된다.
③ 이 반응은 B에 대한 0차 반응이다.
④ 이 반응은 A에 대한 2차 반응이다.
⑤ A의 반감기는 일정한 것은 1차반응이다
9. 다음 중 결합의 극성이 가장 큰 분자는?
① HBr
② HI
③ HCl
④ HF
⑤ H2
답: 4번
수소결합을 하고 있느 HF가 가장 극성이 크다
<전기음성도>
- 공유 결합에서 수소원자를 기준으로 나타낸 전자쌍을 끌어 당기는 힘의 크기
- 전기음성도의 경향성
① 주기율표에서 오른쪽으로, 위로 갈수록 전기음성도가 증가한다
② 전기음성도의 범위는 0.7(Cs,Fr) ~ 4.0(F)
③ 두 원자간 전기음성도 차이가 1.67이상 일땐 이온결합 1.67이하 일땐 극성 공유결합,0 일땐 무극성 공유결합이라고 한다.
- 전기음성도의 이용
① 결합의 극성 결정 전기 음성도가 다른 원소간의 결합에서 전하의 분포 때문에 극성분자가 된다.
② 화학 결합의 구분 전기 음성도가 큰 비금속 원자끼리의 결합은 공유결합이고, 전기 음성도가 작은 금속과 전 기 음성도가 큰 비금속과의 결합은 이온결합이다
- 결합의 극성
1) 극성공유결합
① 원자의 종류가 다른 (비금속)원자간의 공유결합 (HCl,NO,CO,HF등)
② 전기 음성도가 서로 다른 원자들이 전자쌍을 공유하여 형성된 결합 (NH₃, H₂O 등)
③ 분자간의 인력이 작용하므로 녹는점, 끊는점이 높다.
④ 물과 같은 극성용매에 잘 녹는다.
2) 무극성공유결합
① 원자의 종류가 같은 (비금속)원자간의 공유결합 전 기음성도가 서로 같은 원자들이 전자쌍을 공유하여 형성된 결합 예)H₂,O₂,N₂,Cl₂ 등
② 극성공유결합을 하면서도 전하의 분포가 대칭적이면 무극성분자가 된다. 예)CO₂,BF₃,BeH₂,CCl₄
- 분자의 극성
① 극성 분자: 한 분자내의 (+)전하의 중심과 (-)전하 의 중심이 일치하지 않아 분자 내에 부분 전하를 띠 는 분자.비대칭 구조를 이룬다.
② 무극성 분자: 한 분자내의 (+)전하의 중심과 (-)전 하의 중심이 일치하여 분자 내에 부분 전하를 띠지 않는 분자. 대칭구조를 이룬다.
- 극성의 크기
쌍극자 모멘트 (dipole moment) 크기가 같고 부호가 다른 두 전하들이 분리 되어 있을 때 전하와 두 전하 사이의 거리를 곱한 벡터량 (=극성의 크기를 나타냄)
크기: u=qr (q=전하량, r=거리)
방향:(+) → (-) 분리된 전하가 클수록, 거리가 멀수록 크다.
10. 다음 산화환원 반응에 대한 설명으로 옳지 않은 것은? (단, a, b, c, d는 반응 계수이다.)
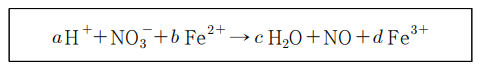
① b는 3이다.
② d는 3이다.
③ a와 c는 4이다.
④ N의 산화수는 감소한다.
⑤ O의 산화수는 변하지 않는다.
답: 3번
풀이
①, ②, ③
- 반응식을 완성해본다 => 산소를 맞춘다 => 수소를 맞춘다
=> 4H+ + NO3- + bFe2+ -> 2H2O + NO + dFe3+
=> b = d
- 전하가 일정해야 한다 => 4 + (-1) + 2b = 2 + 3d
=> b = d를 적용해서 풀어보면 => d = 3 =b
④ N의 산화수는 감소한다.
NO3-에서의 N의 산화수는 +5-, NO에서의 N의 산화수는 +2
+5 -> +2 로 감소했다
⑤ O의 산화수는 변하지 않는다.
-> -2로 일정하다